貓泛白細胞減少症全身炎症反應綜合徵和急性期蛋白、膽固醇和總甲狀腺素濃度的預後價值
 ...
...摘要
背景:貓細小病毒(FPV)是一種常見的、潛在致命的貓傳染性病原體。
目標:評估泛白細胞減少症貓的年齡、絕育狀態、血清澱粉樣蛋白A (SAA)、觸珠蛋白、膽固醇和總甲狀腺素(tT4)的血清濃度以及全身炎症反應綜合徵(SIRS)的預後價值。
動物:客戶擁有的貓感染了FPV,通過糞便ELISA檢測陽性、糞便或血液PCR陽性或兩者均陽性診斷。
方法:回顧性隊列研究。在電子醫療資料庫中搜索2010年1月至2018年1月期間出現的FPV感染貓。根據入院後28天的存活狀態,將貓分為存活者和未存活者。通過單變量和多變量Cox比例風險回歸研究每個變量的預後重要性。最後,使用受試者操作者特徵(ROC)曲線分析來確定區分生存者和非生存者的最佳臨界值,這些臨界值是通過多變量分析確定的具有統計學意義的預後預測因子。
結果:70隻貓參加了這項研究。多變量分析確定只有入院時血清tT4濃度與存活率顯著相關(P = .01)。通過對血清tT4濃度的ROC曲線分析,在區分存活者和未存活者中確定了0.82 μg/dL的臨界值。這個臨界值的敏感性為73.9%,特異性為82.9%(曲線下面積為0.783;95%置信區間,0.668-0.873;P < .0001)。
結論和臨床相關性:入院時血清tT4濃度對FPV感染的貓有預後價值。
關鍵詞:腹瀉和嘔吐、貓感染、傳染病、細小病毒
介紹
細小病毒是貓和其他哺乳動物物種中的傳染性病原體。病毒通過與受污染的物質間接接觸傳播給易感動物。在口咽淋巴組織中最初複製後,病毒血症階段將病毒傳播到所有身體組織。在骨髓和其他淋巴組織中的複製通常導致免疫抑制,這是白細胞數量減少和T細胞反應性受損的結果。通常,病人死於併發症,如繼發性細菌血症、脫水和彌散性血管內凝血病。嚴重疾病在年輕和未接種疫苗的小貓中更常見,死亡率可接近90%。
與犬相比,只有2項研究評估了與貓細小病毒(FPV)感染相關的預後因素。與FPV感染貓未存活風險較高相關的臨床變量是嗜睡、直腸溫度<37.9C和入院時低體重。此外,在患有細小病毒感染的犬中,當入院時符合全身炎症反應綜合徵(SIRS)的標準時,死亡率較高,儘管犬中SIRS的標準標準尚未被普遍接受。與貓預後不良相關的唯一臨床病理變量是白細胞減少症、住院3天後白細胞計數沒有增加、血小板減少症、低白蛋白血症和低鉀血症。在感染細小病毒的犬中,與存活的犬相比,未存活犬的血清總甲狀腺素(tT4)和膽固醇濃度在入院時顯著降低。此外,兩項評估急性期蛋白(APPs)在細小病毒性腸炎犬中的預後價值的研究表明,C-反應蛋白(CRP)在未存活犬中較高,並與死亡風險增加呈正相關。然而,CRP預測預後的能力只是中等程度的準確。
據我們所知,沒有研究調查血清tT4濃度、SIRS或任何血清APPs濃度在預測貓泛白細胞減少癥結果中的作用。此外,沒有研究表明入院時的血清膽固醇濃度與預後有關聯。
因此,為了提高對貓泛白細胞減少症預後的認識,我們的目的是評估入院時FPV感染貓SIRS的存在和血清澱粉樣蛋白A (SAA)、觸珠蛋白、膽固醇和tT4濃度的預後價值。
材料和方法
研究群體和預後因素
計劃進行一項回顧性隊列研究,通過搜索2010年1月至2018年1月期間在「San Marco Veterinary Clinic」的泛白細胞減少症貓的電子醫學資料庫P.O.A System-Plus 9.0來招募病例。具有與FPV感染相符的病史和臨床發現的貓列入本研究,並且通過糞便的直接ELISA檢測(SNAP parvo test,Idexx laboratories,Milan,Italy)和糞便或血液或兩者的陽性PCR (MWG Biotech AG,Ebersberg,Germany)確認了入院時泛白細胞減少症的明確診斷。納入標準是完整的醫療記錄的可用性,包括症狀、病史和體格檢查結果,入院時獲得的血漿和血清樣本,以及28天的隨訪評估。唯一的排除標準是入院前4周內接種FPV疫苗。根據貓入院後28天的存活狀況,將貓分為存活和未存活。因其臨床狀況惡化而實施安樂死的貓或因FPV感染相關併發症而在入院後28天前死亡的貓被視為未存活貓。
進入研究的貓的信息包括性別(分類為絕育與未絕育)、年齡、入院時SIRS的存在、SAA、觸珠蛋白、膽固醇和tT4的血清濃度以及入院後28天的存活狀態。如果患者滿足4個SIRS標準中的至少3個,則診斷為SIRS。SIRS臨界值取自以前對貓的研究:直腸溫度≥39.7C或<37.8C,心率≥225次/分或≤140次/分,呼吸頻率≥40次/分,白細胞計數≥19 500/ μL或≤5000/μL或中性粒細胞分數≥5%。
分析方法
所有臨床病理檢查均在「Laboratorio d’Analisi San Marco」進行。在研究中所有貓入院時,通過頸靜脈穿刺採集5ml血液樣本,進行常規實驗室分析。立即將2ml血液轉移到含有K3-EDTA的抗凝管中,將3mL血液放入普通玻璃管中,使用自動匹配分析儀(Olympus AU 2700,OlympusDiagnostics,Hamburg,Ger-many)進行常規血清生化分析,包括SAA、觸珠蛋白和膽固醇濃度的測量。在樣本採集的同一天,從剩餘血清(如果可用)中測量血清tT4濃度。使用自動化學發光免疫分析儀(Immunolite 2000;Siemens Healthcare GmbH)測量血清tT4濃度。管理每個病例的臨床醫生對tT4結果不知情,並且沒有小貓接受甲狀腺素作為其治療的一部分。
所有的收集程序僅為貓的實驗和標準的診斷和監測目的而進行。均獲得了貓主人知情的書面同意。在研究的任何部分都不需要麻醉和安樂死。所有程序均符合歐洲關於保護科學用途動物的立法(Directive 2010/63/EU)和義大利法律的法律要求(Decreto Legislativo 04/03/2014, n. 26)。因此,我們的研究不需要授權或身份證明協議號碼。
統計分析
使用Shapiro-Wilk檢驗評估連續數據的正態分布。正態分布數據使用平均值±標準差(SD)進行評估,非正態分布的數據報告為中位數和四分位間距(IQR,第25和75百分位)。通過使用Mann-Whitney檢驗(「U」為檢驗統計值)、Fisher精確檢驗(Fisher精確檢驗)、生存者和非生存者之間的比較,研究了年齡、性別(分類為絕育/未絕育)、SIRS的存在、SAA、觸珠蛋白、膽固醇和tT4的血清濃度(初始檢查時記錄)等變量的預後重要性,根據變量的性質和分布,採用耶茨校正卡方檢驗(「χ2」為檢驗統計量)和斯圖登特檢驗(「t」為檢驗統計值)。Cox比例風險模型用於擬合生存狀態(入院後28天)作為因變量與其他預測變量之間的相關性,當作為預測因素進行單變量分析時,P值<.05。最後,採用受試者操作特徵(ROC)曲線分析來確定在多變量分析中被證明具有統計學意義的預後變量的最佳截斷值,以區分生存者和非生存者。
對於所有統計分析,顯著性水平設置為α=0.05。
結果
研究群體
2010年1月至2018年1月期間,128隻診斷為泛白細胞減少症的貓被送到「San Marco Veterinary Clinic」。其中,70隻貓符合研究條件。
在參與研究的70隻貓中,47隻(67%)存活出院(生存者),平均最後隨訪時間為300天(IQR,60-575天)。生存者中,22隻(47%)貓是雌性(7隻未絕育,15隻絕育),25隻(53%)是雄性(15隻未絕育和12隻絕育);生存貓的中位年齡為10個月(IQR,7-18個月),住院時間為5天(IQR)。70隻貓中有23隻(33%)死亡所有這23隻貓都因疾病的進展而死亡。沒有一隻未存活的貓因其臨床狀況惡化或經濟限制而被安樂死。其中,11隻貓(48%)為雌性(7隻未絕育,4隻絕育),12隻(52%)為雄性(7隻未絕育,5隻絕育)。這些未存活貓的平均年齡為7個月(IQR,3-11個月)。所有未存活的貓都在住院期間死亡,只有1隻貓在主人的要求下住院2天後出院,2天後在家中死亡。未存活貓的中位生存時間為3.5天(IQR,3-7天)。未存活貓比存活貓明顯年輕(U,314.5;P=.005),而存活貓和未存活貓在性別(分類為雄性未絕育、雄性絕育、雌性未絕育或雌性絕育)方面沒有顯著差異(P=.36)。
預後因素
入院時,存活貓(9/47,19%)與未存活貓(12/23,52%)之間符合SIRS標準的貓數量存在統計學顯著差異(χ2=8.02;P=0.005)。存活貓的SAA濃度(參考區間,0.1-0.5μg/dL)顯著低於未存活貓(中位數,83.3μg/dR;IQR,0.1-143.4μg/dL)(U=749;P=.009)(中位數,138.3μg/dL:IQR,96.0-167.1μg/d)。存活貓的血清觸珠蛋白濃度(參考區間,18-74 mg/dL)顯著低於未存活貓(平均值,136.13±69.80 mg/dL,平均值,190.09±55.25 mg/dL。存活貓的血清膽固醇濃度(參考區間,95-210 mg/dL)(平均值,142.77±36.48 mg/dL,與未存活貓的平均值,134.22±46.77 mg/dL相比,無顯著差異(t,0.838;P=.40)。最後,存活貓的血清tT4濃度(參考區間,1.21-3.29μg/dL)顯著高於未存活貓(平均值,1.38±0.66μg/dL;圖1)(t,3.546;P=0.001)。
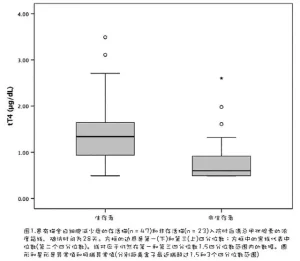 ...
...多變量Cox比例風險回歸結果表明,在控制其他預測因素(表1)後,初始檢查時血清tT4濃度是與生存率顯著相關的唯一因素(風險比,0.26;P=.01)。
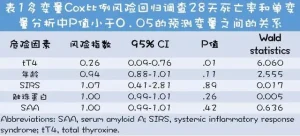 ...
...通過ROC曲線分析確定的血清tT4濃度的最佳臨界值(即區分存活者和非存活者時靈敏度和特異性總和[Youden指數]最大化的值)為0.82 μg/dL。血清tT4濃度≤0.82 μg/dL的敏感性為73.9%,特異性為82.9% (AUC,0.783;AUC的95%可信區間為0.668-0.873;P < .0001)來預測死亡率(圖2)。
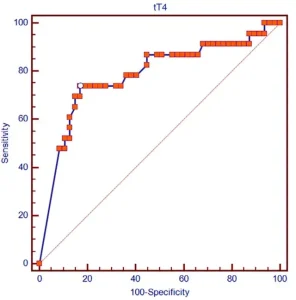 ...
...表2.初始檢查時使用總酪氨酸濃度的受試者操作特徵曲線,以區分28天存活貓和貓泛白細胞減少症的非存活貓。白色圓圈對應於Youden指數,該指數確定了提供最大靈敏度和特異性總和的值
討論
在我們的研究中,多變量分析表明,只有入院時血清tT4濃度才能預測感染FPV的貓的死亡結局。SIRS的存在、血清膽固醇濃度以及入院時評估的所有APPs濃度與這些泛白細胞減少症貓的死亡無關。
危重症的特徵是即使在甲狀腺功能正常的情況下,甲狀腺激素濃度也會發生變化,這種狀態被定義為非甲狀腺疾病(NTI)。這種情況可歸因於3個一般因素:脫碘酶活性的變化、促甲狀腺激素(TSH)分泌的變化以及甲狀腺激素與血清蛋白結合的變化。最近,已經提出了其他機制,如甲狀腺激素進入組織的運輸改變和核甲狀腺激素受體活性改變。在人類醫學中,危重症患者血清T4濃度低與預後差之間存在相關性。人們對NTI患者體內的激素替代存在一些擔憂,但迄今為止對這一問題缺乏共識。危重症是導致犬和貓NTI的原因。在犬身上,許多研究評估了甲狀腺激素對患病患者的預測意義。已經確定,患有NTI的貓的血清tT4濃度隨著疾病的惡化而逐漸降低。另一項針對患有與甲狀腺無關的各種疾病的貓的研究表明,血清tT4濃度與死亡率呈負相關。然而,據我們所知,在貓身上沒有研究評估甲狀腺激素濃度對特定疾病的預後價值。我們的結果表明,入院時血清tT4濃度與FPV感染貓的預後相關。這一觀察結果與前面提到的研究結果一致。
除了我們研究的主要目的,我們還研究了其他預測因素如年齡和性別(分類為絕育或未絕育)與生存率的可能聯繫,儘管兩組在這些變量上並不匹配。事實上,小貓被認為更容易感染FPV病毒,據報導,在3至5個月大時發病率和死亡率最高,但這一假設是基於專家意見,尚未得到觀察研究的證實。在我們的研究中,年齡在單變量分析中顯示為一個預後因素,但在多變量分析中,它不再與預後相關。因此,這一結果與普遍認為的相反,但與另一項研究一致。相反,泛白細胞減少症患者的性別似乎沒有預測作用。事實上,在探索性單變量分析中,性別(分類為未絕育或絕育)與我們研究中的預後無關,這與以前關於貓的報導一致。
貓SIRS的標準尚未很好地確定,報告了不同的納入標準。為了我們的研究,SIRS的診斷是根據最近在貓身上使用的標準進行的。然而,為了增加SIRS標準的特異性,我們選擇了≥3個標準的存在,而不是之前對貓的研究所建議的≥2個標準。考慮到FPV對腸上皮細胞的破壞作用,革蘭陰性內毒素血症可導致SIRS發生或增強,這是全身FPV感染的常見後遺症。這一假設得到了實驗性感染FPV的無特定病原體小貓表現出的溫和臨床症狀的支持。當存在SIRS時,SIRS可能導致該亞組患者出現NTI。因此,儘管SIRS在多變量預後模型中不是一個重要的預測因子,但SIRS仍可能在決定最終結果中發揮間接作用,並有助於NTI的存在。不同的SIRS標準可能產生不同的結果。考慮到SIRS狀態的潛在預後價值,我們認為需要就貓這種情況的最終定義達成共識。
儘管APPs在臨床貓科動物臨床中得到了廣泛應用,但幾乎沒有證據表明其對患病貓的預後作用。最近,研究了入院時測量的SAA濃度對危重貓傳染性和非傳染性SIRS的潛在診斷價值。入院時SAA濃度與最終結果之間沒有關聯。同樣,我們的研究也沒有確定入院時APPs的血清濃度在預測FPV感染貓的結果中的預後作用。 有可能縱向監測,而不是一個單一的APP測定,可以更好地預測結果,如犬的研究所示。
我們沒有發現泛白細胞減少症存活和未存活貓的血清膽固醇濃度有任何差異。這一結果與另一項研究一致。然而,在犬細小病毒(CPV)感染的犬中,未存活的犬的血清膽固醇濃度明顯低於存活的犬。一種可能的解釋來自於細小病毒在犬和貓身上的不同生物學行為。在我們看來,臨床證據表明,與犬中的CPV感染相比,貓中由FPV引起的胃腸道症狀不太常見且較輕。事實上,犬的細小病毒感染歷史上被稱為犬細小病毒腸炎,而貓的細小病毒病傳統上被稱為貓泛白細胞減少症。因此,因為低膽固醇血症也是胃腸道症狀嚴重程度的標誌,所以患有低膽固醇血症(可能是該疾病的更嚴重形式)的犬也具有更差的結果就不足為奇了。
有幾個限制可能影響了我們的研究。首先,我們排除了疫苗接種史不一致的貓和住院前4周內接種過疫苗的貓。我們使用這一標準是因為接受改良活疫苗(MLV)的貓可能會釋放疫苗病毒,因此在接種疫苗後2周,糞便樣本的直接ELISA檢測可能出現假陽性結果。無論如何,在用MLV接種CPV疫苗的犬中,繼發病毒血症或糞便脫落被證明持續了2周,從而潛在地干擾了PCR測試。雖然還沒有對貓進行類似的研究,但我們排除了出現與FPV感染相適應的臨床症狀前4周內接種疫苗的貓,以限制假陽性貓的納入。其次,由於病例選擇的回顧性性質,不可能確保一個標準的血液採樣方案,從而導致一些病例被排除在研究之外。事實上,如果患者的健康狀況看起來過於危急,或者患者缺乏依從性,或者因為主人的經濟限制,就不會收集樣本。第三,在8年的研究中,治療程序可能發生了一些變化,影響了泛白細胞減少症治療標準方案的制定,因此可能會影響每隻貓的預後結果。限制這項研究統計能力的另一個限制可能在於,與存活的貓相比,沒有存活下來的貓數量較少。儘管回溯性研究存在種種局限性,但我們認為所使用的多變量方法以及缺乏獨特和系統的排除原因並沒有從實質上影響結果的穩健性。
結論
我們發現,FPV感染貓入院時的血清tT4濃度可以作為預測疾病轉歸的預後因素。需要通過對APPs和SIRS狀態的系列監測進行進一步的研究,以更好地評估它們在這種常見的貓傳染病中的預後相關性。
感謝
2018年6月,在義大利索倫托舉行的國際貓科動物醫學學會第17屆年會上,初步數據以摘要形式呈現。
利益衝突聲明
作者聲明沒有利益衝突。
標籤外抗菌聲明
作者聲明沒有抗生素的適應症外使用。
機構動物護理和使用委員會(IACUC)或其他批准聲明
作者聲明不需要IACUC或其他批准。
人類倫理批准聲明
作者聲明這項研究不需要人類倫理批准。
參考文獻
1. Steinel A, Parrish CR, Bloom ME, Truyen U. Parvovirus infections in wild carnivores. J Wildl Dis. 2001;37:594-607.
2. Truyen U, Addie D, Belàk S, et al. Feline Panleukopenia: ABCD guide- lines on prevention and management. J Feline Med Surg. 2009;11: 538-546.
3. Stuetzer B, Hartmann K. Feline parvovirus infection and associated diseases. Vet J. 2014;201:150-155.
4. Greene CE. Feline enteric viral infections. In: Greene CE, ed. Infectious Disease of the Dog and Cat. 4th edition, St. Louis, MO: Elsevier Inc; 2012:80-91.
5. Cave T, Thompson H, Reid S. Kitten mortality in the United Kingdom: a retrospective analysis of 274 histopathological examinations (1986 to 2000). Vet Rec. 2002;151(17):497-501.
6. Kruse BD, Unterer S, Horlacher K, Sauter-Louis C, Hartmann K. Prog- nostic factors in cats with feline panleukopenia. J Vet Intern Med. 2010;24:1271-1276.
7. Yilmaz Z, Senturk S. Characterisation of lipid profiles in dogs with parvoviral enteritis. J Small Anim Pract. 2007;48:643-650.
8. Schoeman JP, Goddard A, Herrtage ME. Serum cortisol and thyroxine concentrations as predictors of death in critically ill puppies with parvoviral diarrhea. J Am Vet Med Assoc. 2007;231:1534-1539.
9. Kalli I, Leontides LS, Mylonakis ME, et al. Factors affecting the occur- rence, duration of hospitalization and final outcome in canine parvovi- rus infection. Res Vet Sci. 2010;89:174-178.
10. Dossin O, Rupassara SI, Weng H-Y, Williams DA, Garlick PJ, Schoeman JP. Effect of Parvoviral enteritis on plasma Citrulline con- centration in dogs. J Vet Intern Med. 2011;25:215-221.
11. Ling M, Norris JM, Kelman M, Ward MP. Risk factors for death from canine parvoviral-related disease in Australia. Vet Microbiol. 2012; 158:280-290.
12. Goddard A, Leisewitz AL, Christopher MM, Duncan NM, Becker PJ. Prognostic usefulness of blood leukocyte changes in canine parvoviral enteritis. J Vet Intern Med. 2008;22:309-316.
13. Kocaturk M, Martinez S, Eralp O, Tvarijonaviciute A, Ceron J, Yilmaz Z. Prognostic value of serum acute-phase proteins in dogs with parvoviral enteritis. J Small Anim Pract. 2010;51:478-483.
14. McClure V, van Schoor M, Thompson P, et al. Evaluation of the use of serum C-reactive protein concentration to predict outcome in puppies infected with canine parvovirus. J Am Vet Med Assoc. 2013; 243:361-366.
15. Porporato F, Horzinek M, Hofmann-Lehmann R. Survival estimates and outcome predictors for shelter cats with feline panleukopenia virus infection. J Am Vet Med Assoc. 2018;253:188-195.
16. Hauptman J, Walshaw R, Olivier N. Evaluation of the sensitivity and specificity of diagnostic criteria for sepsis in dogs. Vet Surg. 1997;26: 393-397.
17. Okano S, Yoshida M, Fukushima U, Higuchi S, Takase K, Hagio M. Usefulness of systemic inflammatory response syndrome criteria as an index for prognosis judgement. Vet Rec. 2002;150:245-246.
18. de Laforcade AM, Freeman LM, Shaw SP, et al. Hemostatic changes in dogs with naturally occurring sepsis. J Vet Intern Med. 2003;17: 674-679.
19. Schoeman JP, Herrtage ME. Serum thyrotropin, thyroxine and free thyroxine concentrations as predictors of mortality in critically ill puppies with parvovirus infection: a model for human paediatric criti- cal illness? Microbes Infect. 2008;10:14-18.
20. Babyak J, Sharp C. Epidemiology of systemic inflammatory response syndrome and sepsis in cats hospitalized in a veterinary teaching hos- pital. J Am Vet Med Assoc. 2016;249:65-71.
21. Warner MH, Beckett GJ. Mechanisms behind the non-thyroidal ill- ness syndrome: an update. J Endocrinol. 2010;205:1-13.
22. Farwell AP. Nonthyroidal illness syndrome. Curr Opin Endocrinol Dia- betes Obes. 2013;20:478-484.
23. Boonen E, Van den Berghe G. Endocrine responses to critical illness: novel insights and therapeutic implications. J Clin Endocrinol Metab. 2014;99:1569-1582.
24. Wang Y, Heng J, Yan J, et al. Relationship between disease severity and thyroid function in Chinese patients with euthyroid sick syn- drome. Med. 2018;97:1-5.
25. Angelousi AG, Karageorgopoulos DE, Kapaskelis AM, Falagas ME. Association between thyroid function tests at baseline and the out- come of patients with sepsis or septic shock: a systematic review. Eur J Endocrinol. 2011;164:147-155.
26. Steiner M, Vet M, Pashmakova MB, et al. Evaluation of serum thyroid hormones in dogs with systemic inflammatory response. J Vet Emerg Crit Care. 2014;24:264-271.
27. Giunti M, Troia R, Battilani M, et al. Retrospective evaluation of circu- lating thyroid hormones in critically ill dogs with systemic inflamma- tory response syndrome. J Vet Sci. 2017;18:471-477.
28. Schoeman JP, Rees P, Herrtage ME. Endocrine predictors of mortality in canine babesiosis caused by Babesia canis rossi. Vet Parasitol. 2007;148:75-82.
29. Kumar A, Varshney JP, Varshney VP. Endocrine dysfunction in chronic severe Ehrlichiosis with or without Babesiosis in dogs. Vet Res Commun. 2006;30:911-916.
30. Peterson ME, Melián C, Nichols R. Measurement of serum concentra- tions of free thyroxine, total thyroxine, and total triiodothyronine in cats with hyperthyroidism and cats with nonthyroidal disease. J Am Vet Med Assoc. 2001;218:529-536.
31. CT M, Little C, Macrae A. Effect of illness not associated with the thy- roid gland on serum total and free thyroxine concentrations in cats. J Am Vet Med Assoc. 1996;208:2004-2008.
32. Brady CA, Otto CM, Van Winkle TJ, King LG. Severe sepsis in cats: 29 cases (1986-1998). J Am Vet Med Assoc. 2000;217:531-535.
33. Declue AE, Delgado C, Chang C, et al. Clinical and immunologic assessment of sepsis and the systemic inflammatory response syn- drome in cats. J Am Vet Med Assoc. 2011;238:890-897.
34. Parrish CR. Pathogenesis of feline panleukopenia virus and canine parvovirus. Baillieres Clin Haematol. 1995;8:57-71.
35. Troìa R, Gruarin M, Foglia A, Agnoli C, Dondi F, Giunti M. Serum amyloid A in the diagnosis of feline sepsis. J Vet Diagn Invest. 2017;29:856-859.
36. Tsujimoto H, Takahashi M, Tamamoto T, et al. Serum amyloid a as a prognostic marker in cats with various diseases. J Vet Diagn Invest. 2013;25:428-432.
37. Gebhardt C, Kohn B, Schweigert FJ, et al. Use of C-reactive protein to predict outcome in dogs with systemic inflammatory response syn- drome or sepsis. J Vet Emerg Crit Care. 2009;19:450-458.
38. Torrente C, Manzanilla EG, Bosch L, et al. Plasma iron, C-reactive protein, albumin, and plasma fibrinogen concentrations in dogs with systemic inflammatory response syndrome. J Vet Emerg Crit Care. 2015;25:611-619.
39. Houston D, Ribble C, Head L. Risk factors associated with parvovirus enteritis in dogs: 283 cases (1982-1991). J Am Vet Med Assoc. 1996; 208:542-546.
40. Burchell RK, Schoeman JP, Leisewitz AL. The central role of chloride in the metabolic acid-base changes in canine parvoviral enteritis. Vet J. 2014;200:152-156.
41. Nappert G, Dunphy E, Ruben D, Mann FA. Determination of serum organic acids in puppies with naturally acquired parvoviral enteritis. Can J Vet Res. 2002;66:15-18.
42. Gaykwad C, Garkhal J, Chethan GE, Nandi S, de UK. Amelioration of oxidative stress using N-acetylcysteine in canine parvoviral enteritis. J Vet Pharmacol Ther. 2018;41:68-75.
43. Mohr A, Leisewitz A, Jacobson L, et al. Effect of early enteral nutrition on intestinal permeability, intestinal protein loss, and outcome in dogs with severe Parvoviral enteritis. J Vet Intern Med. 2003;17:791-798.
44. Litster A, Benjanirut C. Case series of feline panleukopenia virus in an animal shelter. J Feline Med Surg. 2014;16:346-353.
45. Patterson EV, Reese MJ, Tucker SJ, Dubovi EJ, Crawford PC, Levy JK. Effect of vaccination on parvovirus antigen testing in kittens. J Am Vet Med Assoc. 2007;230:359-363.
46. Neuerer FF, Horlacher K, Truyen U, Hartmann K. Comparison of dif- ferent in-house test systems to detect parvovirus in faeces of cats. J Feline Med Surg. 2008;10:247-251.
47. Decaro N, Crescenzo G, Desario C, et al. Long-term viremia and fecal shedding in pups after modified-live canine parvovirus vaccination. Vaccine. 2014;32:3850-3853.
